Anne-Sophie Chrétien (IPC/AMU), chercheure MCU-PH au sein de l’équipe Immunité et Cancer du CRCM dirigée par le Dr Jacques Nunès et le Pr Daniel Olive, nous parle de ses travaux récemment publiés dans la revue scientifique PNAS : High-dimensional mass cytometry analysis of NK cell alterations in AML identifies a subgroup with adverse clinical outcome.
Ce projet a bénéficié d’un fort soutien du Canceropôle Provence-Alpes-Côte d’Azur, notamment via un premier financement en 2014, puis de deux autres en 2016 dans le cadre des appels « Émergence » et « EmA – Émergence & Accompagnement ».
Pouvez-vous nous en dire plus sur les résultats de vos travaux ?
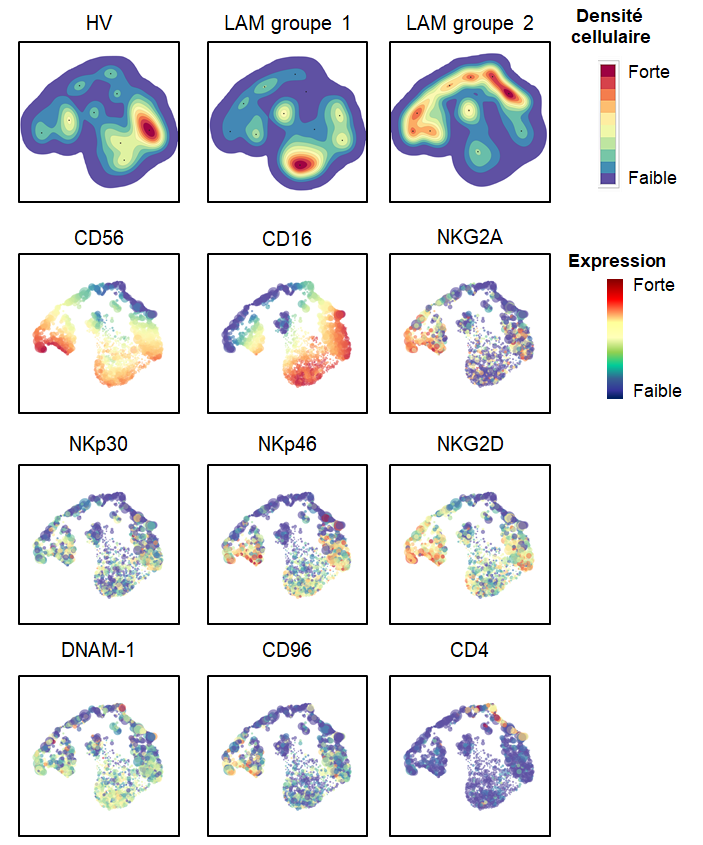
Nous venons de mettre en évidence une nouvelle anomalie du système immunitaire dans la leucémie aiguë myéloïde. Cette anomalie porte sur une population de cellules « tueuses naturelles » ou cellules NK (pour Natural Killer), des cellules de l’immunité innée qui sont capables de détecter des cellules infectées par des virus ou encore des cellules tumorales et de les éliminer. Pour échapper à cette surveillance du système immunitaire, la cellule tumorale peut induire des altérations phénotypiques, c’est-à-dire de modifier l’expression de protéines exprimées à la surface des cellules immunitaires, aboutissant généralement à une perte des fonctions anti-tumorales.
Dans cet article, nous décrivons une augmentation de la fréquence de cellules Natural Killer dites non conventionnelles (CD56–CD16+) chez les patients atteints de leucémie aiguë myéloïde. Cette anomalie est caractérisée par l’expression de la protéine CD16 et l’absence d’expression de la protéine CD56, une protéine clé impliquée dans l’adhérence des cellules NK à la cellule tumorale, aboutissant par la suite à la lyse de cette dernière. De plus, cette interaction joue un rôle déterminant dans la coordination entre immunité innée et immunité adaptative, grâce notamment à la sécrétion de cytokines.
Nos résultats suggèrent ainsi que l’accumulation de cellules NK non -conventionnelles pourrait être une caractéristique importante de l’échappement de la cellule tumorale à l’immunité innée au cours de la progression de la leucémie aiguë myéloïde.
Il semblerait que cette étude soit le fruit d’un travail très interdisciplinaire. Vous nous expliquez ?
En effet, il s’agit là d’un travail coordonné entre les chercheurs, ingénieurs et techniciens de l’équipe Immunité et Cancer du CRCM ainsi que les cliniciens du département d’hématologie de l’Institut Paoli-Calmettes. De plus, une collaboration étroite avec l’équipe de recherche bio-informatique intégrative du CRCM a permis l’utilisation de systèmes d’intelligence artificielle – algorithmes de machine learning – pour extraire des informations centrales sur l’origine potentielle de cette anomalie à partir de jeux de données complexes générés par une technologie innovante, la cytométrie de masse (CyTOF). Cette technologie est implantée sur le site de l’Institut Paoli-Calmettes et du CRCM depuis 2018, et financée par des fonds FEDER. Les premiers projets de développement des protocoles expérimentaux mis en place en collaboration avec le Centre d’ImmunoPHEnomique de Luminy (CIPHE) et le CIML, essentiels au démarrage de l’étude, ont été soutenus financièrement par le Canceropôle Provence-Alpes-Côte d’Azur, l’INCa et ITMO Cancer.
Quel est l’enjeu de cette découverte pour la clinique ?
Jusqu’à présent, une augmentation du nombre de cellules NK non-conventionnelles n’avait été décrite que dans des infections virales chroniques sévères telles que les infections à VIH. Nous avons pu montrer qu’environ un quart des patients atteints de leucémie aiguë myéloïde possèdent cette anomalie au diagnostic. Ce sous-groupe de patients présente un risque accru de résistance aux traitements par chimiothérapie.
Ces résultats font écho à deux autres études que nous avons publiées récemment (Chrétien AS et al. Frontiers in Immunology 2015 et Chrétien AS et al. Frontiers in Immunology 2017). Dans ce travail, un blocage de maturation des cellules NK à des stades précoces du développement concernait environ 10% des patients, pour lesquels le pronostic était particulièrement sombre. Par conséquent, une maturation normale des cellules NK semble être essentielle pour le contrôle de la maladie.
Quelles sont les perspectives ?
Nous poursuivons l’étude et analysons les caractéristiques moléculaires et métaboliques des NK non-conventionnelles. En parallèle, nous développons un modèle cellulaire qui nous permettra d’induire et étudier l’anomalie, s’affranchissant ainsi de la contrainte de travailler sur des populations restreintes de cellules de patients. Le travail entamé vise à développer un protocole robuste permettant de rétablir la fonction anti-tumorale de cette population de NK.
L’exploration des mécanismes impliqués dans la dérégulation de la maturation des cellules NK ouvrira de nouvelles opportunités thérapeutiques pour restaurer les fonctions de ces cellules chez les patients atteints de leucémie.